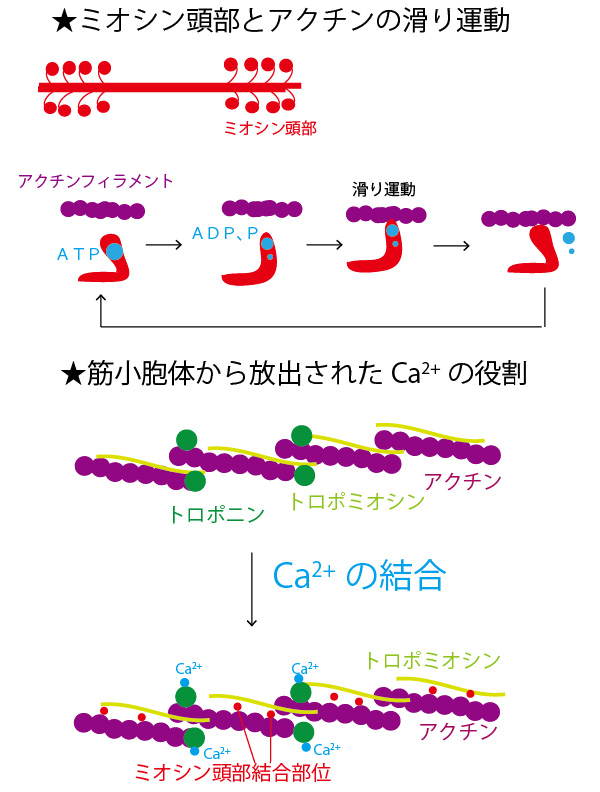
アクチンフィラメントの構 造が変化し,ミオシン頭部 と接着 ミオシン頭部の atpアーゼ によりatpが加水分解し, ミオシン頭部の立体構造が 変化 (首を振るような) ミオシンは接着しているア クチンフィラメントをたぐ り寄せる.アクトミオシン がアクチン トロポミオシンが結合している。トロポニン(―) ミオシン L メロミオシンによってアクチン結合部位が被覆されている。 中間径フィラメント: ビメンチン vimentin デスミン desmin 3)平滑筋の収縮調節 Ca アクチンとミオシンの2種類の並びをみた場合に、その重なりは3つに分類されます。 アクチンだけのところ アクチンとミオシンが重なっているところ ミオシンだけのところ ミオシンの影響力は強く、ミオシンさんがいるだけでa帯となります。 つまり、a帯は
大学入試共通テスト 生物 第2回試行調査第1問 配点12点 筋肉運動のしくみ 問題 解答 解説 船橋市議会議員 朝倉幹晴公式サイト
アクチン ミオシン ソーセージ
アクチン ミオシン ソーセージ- 筋トレの分子生物学シリーズ第 5 弾.筋収縮の主体であるアクチンとミオシンについて.タイチンについて最近分かってきた点にも言及する. 山本義徳オフィシャルブログ は学術的にも詳細なことで有名であるが, 18 年 9 月 27 日時点では,タイチンにている分子機械である。ミオシンというタンパク質モーター はアクチンフィラメントのレールの上をa t p が加水分解され るときのエネルギーを使って滑り運動をする。1分子計測に よって、ミオシン1分子がa t p 1分子を使って数~数十ナノ



2
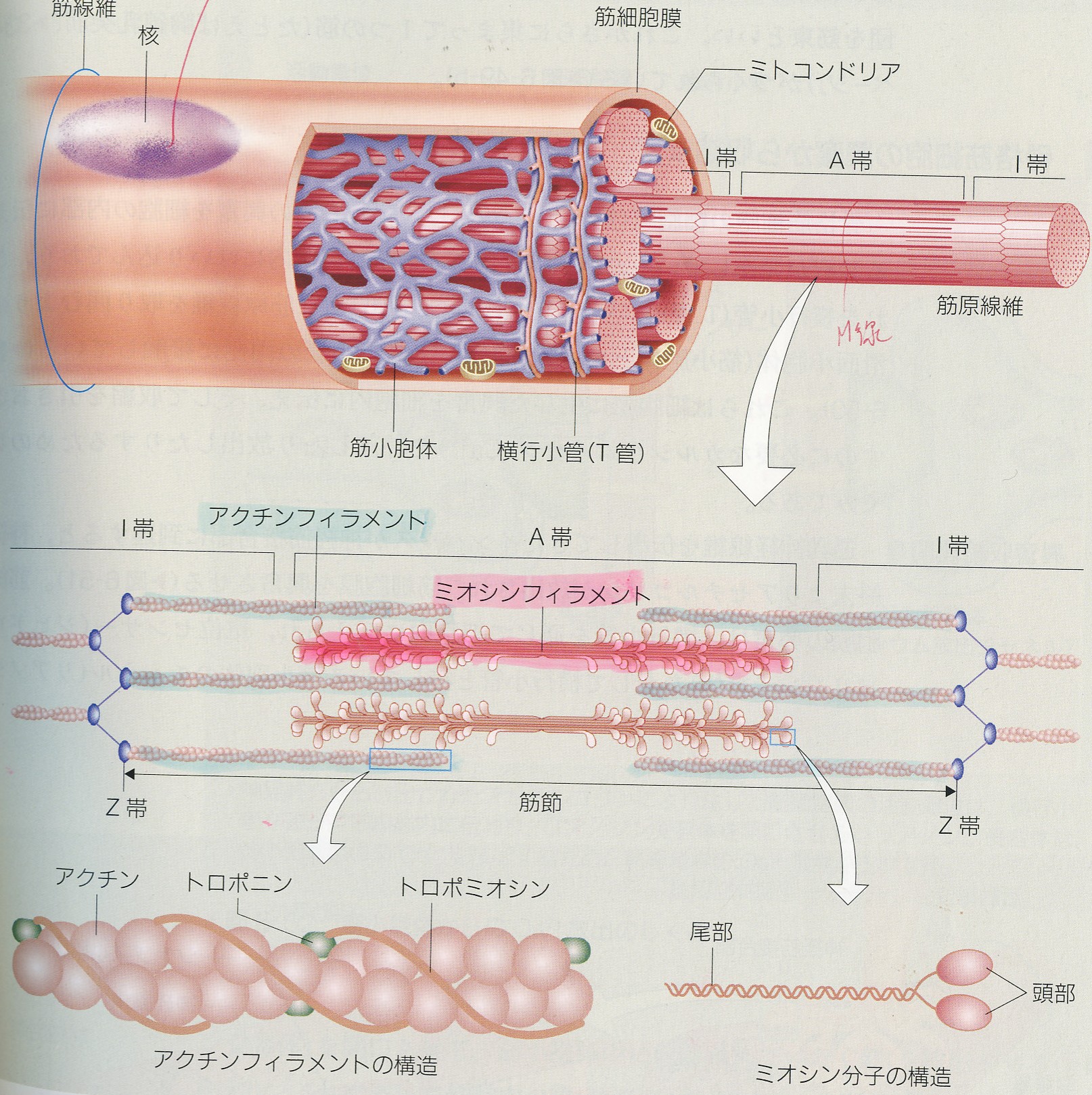
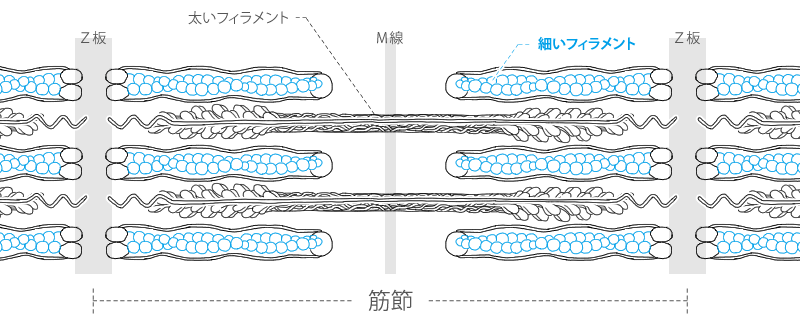
アクチンフィラメントとミオシンフィラメント 筋原線維は筋収縮に重要なミオシンフィラメントとアクチンフィラメントを内包した細胞内の小器官であり、2つのZ板の間の筋収縮の最小単位である 筋節(サルコメア) の繰り 返しによって形成されている。 筋節 (サルコメア)は、筋収縮に重要なタンパク質であるアクチン重鎖とミオシン重鎖が部分的に重なり合って 筋収縮は筋細胞の中にあるタンパクの線維の束が縮むことによっておこる。 この束の収縮は,タンパク線維の分子が縮むのではなくて, 横に並んだ ミオシン(myosin) と アクチン(actin) という2種類のタンパク線維(フィラメント)の位置関係が動く(滑る) ことによって生じる。 この考え方を筋収縮の「 滑走説 (かっそうせつ)」(滑り説;sliding theory)と新着細胞生物学用語集 (アクチン・ミオシン) アクチン細胞骨格は、負に帯電した細胞膜の直下において機能することから、酸性脂質(主にリン脂質)による直接的な制御を受けるのではないかと考えられてきた。 実際、試験管内において、イノシトールリン脂質PIP2を含む人工膜小胞(リポソーム)をカエル卵抽出液中に添加すると、「アクチンコメット」と呼ばれる
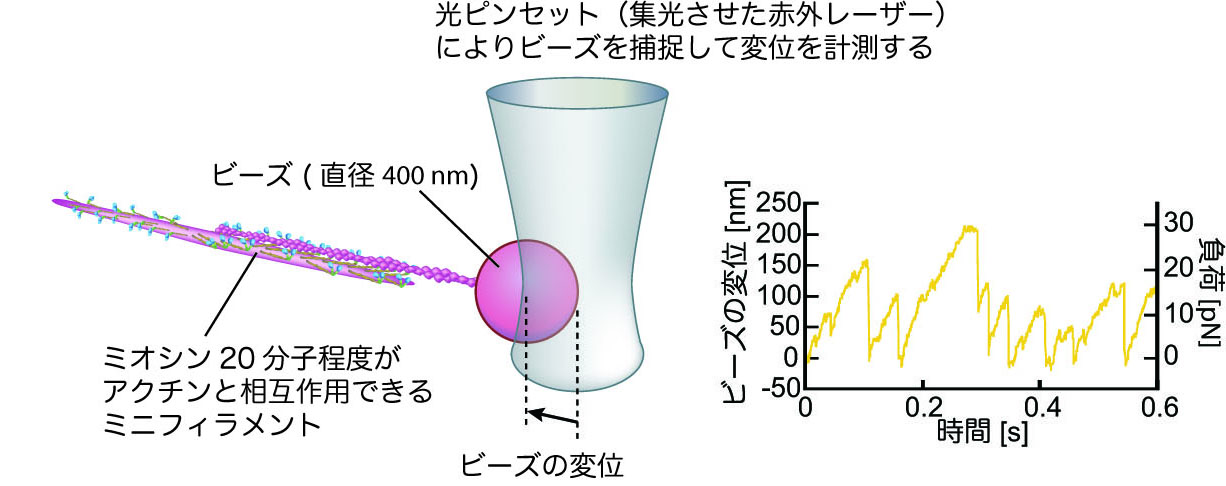
心筋ミオシン 15 分子程度がアクチン 1 本と相互作用できるフィラメントを合成し、このミオシンフィラメントがアクチンと相互作用するときの力を、光ピンセットを用いて計測しましこのように、ミオシンはアクチンフィラメントを動かす働きをするので、「 モータータンパク質 」と呼ばれます。 二の腕の力こぶだけでなく、体を動かすときは必ず筋肉を使うので、ムキっと盛り上がらなくても筋収縮は起こっています。ミオシンみおしんmyosin 筋肉 を構成する タンパク質 の一つで、1942年セント・ジェルジーによって単離された。 アクチン とともに、筋原線維(筋線維内に多数縦走する円筒状の微細構造)の主要な構成要素で、ウサギの骨格筋では筋原線維タンパク質の50%前後を占める。 サルコメア(筋原線維中の線維方向にみられる繰り返しの単位)の太いA フィラメント (長
主な違い アクチンとミオシン 筋肉はタンパク質で構成されています。 アクチンとミオシンは筋肉内の2つのタンパク質で、動物の筋肉収縮に関与しています。 それらは、トロポミオシン、トロポニン、およびメロミオシンとして知られる調節タンパク質と協調して身体の自発的な筋肉の動きを制御します。 アクチンおよびミオシンタンパク質は、筋原線維に縦 骨格筋における死後硬直の解除機構に関する研究 アクチンミオシン相互作用の死後変化 Authors 中村, 富美男 Browse this author Issue Date 25Mar1981 Conffering University 北海道大学 Degree Report Number 甲第1678号細胞分裂は染色体の分離とそれにつづく細胞質の分裂の連続した過程である.動物の細胞では,1968年,電子顕微鏡による観察により収縮環が発見され 1) ,そのおもな成分はアクチンフィラメントであることがわかった 2) .1977年,細胞質分裂はアクチンとミオシンとの相互作用により起こることが判明した 3) .これらのことから,細胞質分裂はアクチンとミオシンと



筋肉のタンパク質 ミオシンの協同的な力発生を発見 東京大学 大学院理学系研究科 理学部



Topic 5 心筋収縮のx線回折法による観察 Spring 8 Web Site
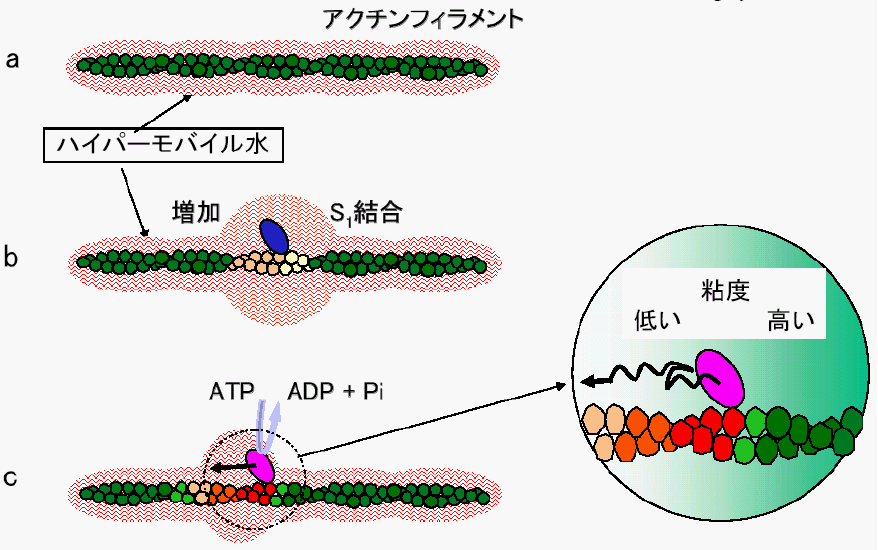
だし、ミオシンはアクチン線維という"レール"の上を、一方向 へ移動します(図下)。水分子などの衝突によるブラウン運動の 方向はランダムです。ミオシンはなぜ進行方向が分かるのか。 09年、私たちはその仕組みを解明しました。ブラウン運動ミオシンATPase活 性の測定は,37。CでATPを 基質として遊離してくる無機リン酸の量をFiskeSubbarow法8)で 定量した 消化を受けたミオシン分子のアクチンに対する 作用は,ア クトミオシンに基づく高いMg2ATP ase活 性(25。C)とG一 アクチンの重合化に基づ く粘度変化9)(25。ミオシンは,atp を加水分解し,得られるエネルギー を用いてアクチンフィラメントを動かす(または,自分自 身がアクチンフィラメント上を動く)モータータンパク質 である.平滑筋ミオシンは,ミオシンスーパーファミリー



Sts Home




5分でわかる ハックスレーの滑走説 筋が収縮する仕組みを現役大学院生が解説 ページ 2 2 Study Z ドラゴン桜と学ぶwebマガジン
アクチン単量体上にはミオシン分子との結合部位がある 弛緩状態ではTm分 子がその結合部位を"塞ぐ"ためにア クチン・ミオシンの相互作用が阻害されるが,Tnへ のカ ルシウムイオンの結合によりTm分 子が移動することにアクチンフィラメント中のアクチン分子はそれぞれ1個の ii型ミオシン頭部と結合。 アクチンおよびミオシンフィラメントの極性は中央線の両側で逆向き。 滑り説:収縮は太いミオシンフィラメントと細いアクチンフィラメントの滑りあいによる。通り,アクチン線維とミオシン線維が部分的に重複 しながら規則正しく整列した精密な構造である。ア クチン線維は単量体アクチンが方向性をもってらせ ん状に重合した線維であるが,サルコメア内では一 定方向を向いている。プラス端(反矢じり端)がZ



プレスリリース Mast21 東北大学 マテリアル 開発系




筋線維のタイプ 深めろ筋トレ知識 ストレングス学園 Vol 3 Tarzan Web ターザンウェブ
アクチン、ミオシン、アクトミオシン 繊維状で筋肉の収縮に関与 加熱することで収縮し、硬くなる 筋形質たんぱく質 ミオグロビン、酵素など 解糖酵素を含む ミオグロビンは魚肉の血合い肉 結合組織たんぱく質 コラーゲン 加熱によって凝固アクチンとミオシンの結合体。 新鮮な筋肉のひき肉を、濃い塩化カリウム 溶液で抽出し、注射器で水の中に押し出すとゼリー状の紐(ひも)ができる。 これは天然のアクトミオシンであるが、これにatp(アデノシン三リン酸)を加えるときゅっと縮まる。 すなわち、atpアーゼ活性を示す。ミオシン,アクチン,トロポミオシンおよびトロポニンはともに,筋繊維の蛋白質の 3/4 以上を占める。 その他 種ほどのタンパク質が含まれる。 これらのタンパク質はサルコメア( 筋節 )中の筋繊維の組織化に関わり,また細胞膜および細胞外基質へ




アクチンとは コトバンク




トリガーポイント発生のメカニズム やまだカイロプラクティック 鍼灸院ホーム ページ
About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy & Safety How works Test new features Press Copyright Contact us Creators




筋の収縮のメカニズム 骨格筋の機能 看護roo カンゴルー




生体を動かすタンパク質



1




026 ミオシンとアクチンの相互作用 Interaction Of Myosin And Actin Gb 115b02 基礎医学教育研究会 Kikken Lab



居合と科学 筋収縮 12 富山de居合 無涯塾日記




Special Story 生命をささえる運び屋分子 Brh Jt生命誌研究館
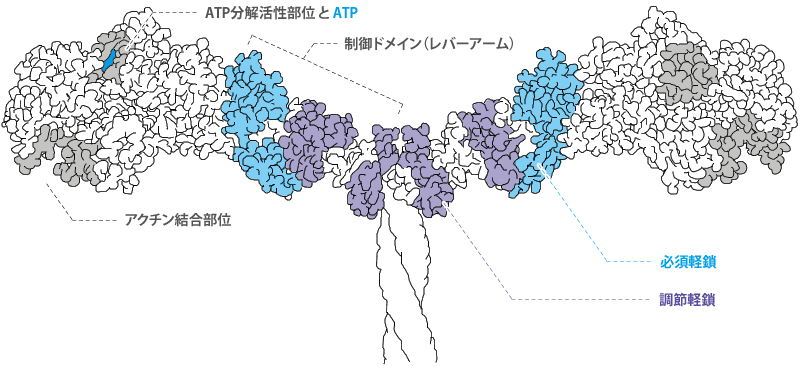



筋のタンパク質 アクチン ミオシン



2



名古屋市科学館 科学館を利用する 展示ガイド フロアマップ 骨と筋肉 筋肉の収縮




アクチンとミオシン 複雑な薄いフィラメントのトロポニンの太いフィラメントを示す筋肉組織の詳細 のイラスト素材 ベクタ Image
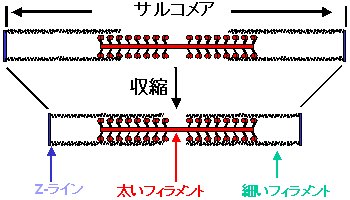



筋収縮のエネルギー変換機構を解明 すべての細胞運動 細胞内輸送に共通の機構が明らかに



アクチン ミオシン mサイズ Laiman Stockweb メディカルイラスト素材のダウンロード販売



Spring 8放射光により解明された筋収縮蛋白ミオシンの意外な振舞 トピック Spring 8 Web Site




アクチンフィラメント系による細胞運動 筋収縮 Study Channel
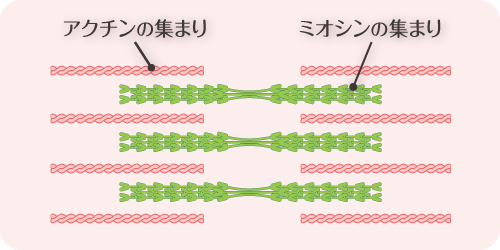



ハンバーグを作るときによくこねるのはなぜ Z Square Z会



1
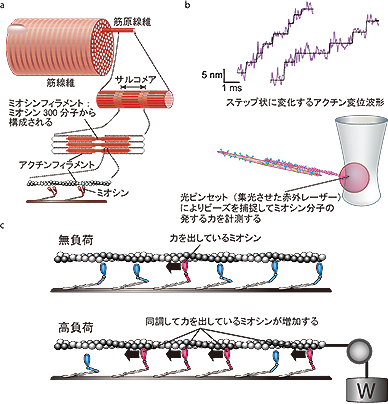



学部生に伝える研究最前線 筋のタンパク質ミオシン分子達は綱引きチーム 東京大学 大学院理学系研究科 理学部



1




筋収縮はどのようなメカニズムで収縮するのか 痛み取り専門 楽楽痛み研究会 公式サイト



2



収縮タンパク質 はどんな働きをする よくある質問 財団法人日本食肉消費総合センター




筋トレの分子生物学 5 アクチンとミオシン タイチン Hymn
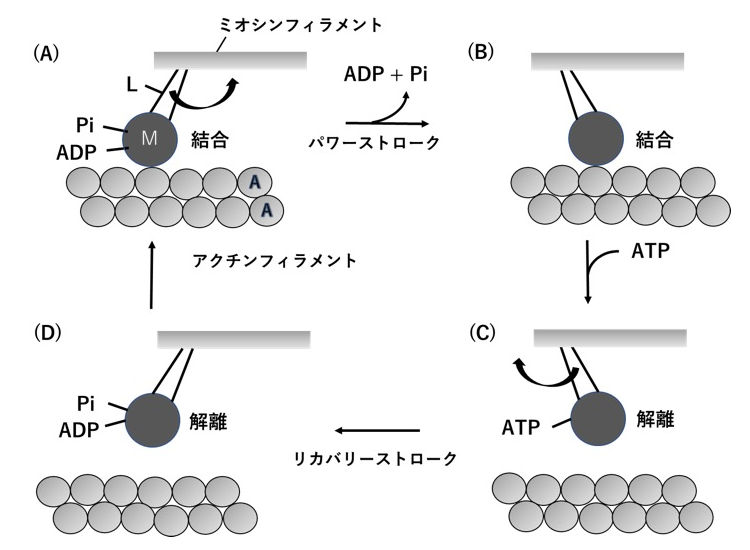



骨格筋収縮時のミオシン分子頭部とアクチンフィラメント間の硬直結合の構造に関する研究 Studies On The Structure Of Linkages Between Myosin Head And Actin Filament During Contraction In Skeletal Muscle Spring 8 Sacla 利用研究成果集



理学療法と東洋医学の接点を求めて アクチン ミオシン 横紋筋



Uyeda Lab Research




プレスリリース Mast21 東北大学 マテリアル 開発系
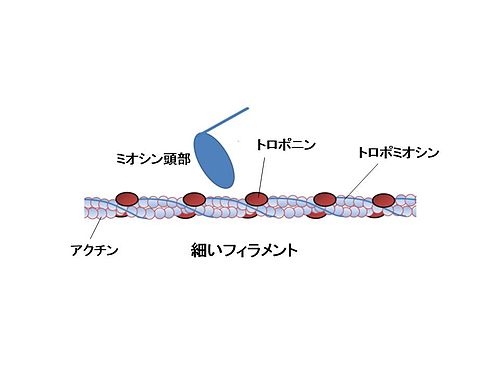



トロポニン Wikipedia




骨格筋の構造 動く 3 看護roo カンゴルー
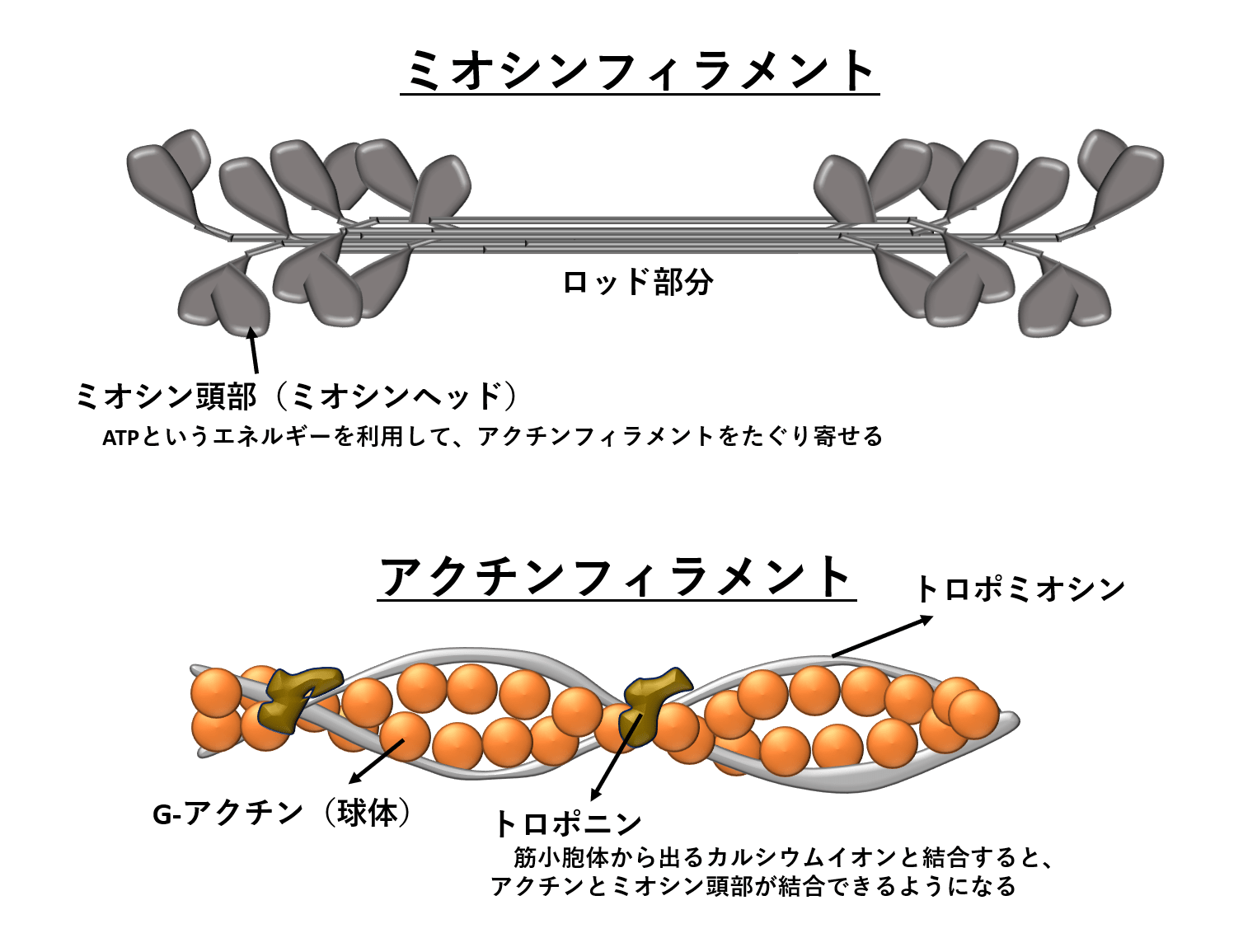



一発で覚える 筋収縮の仕組み 陸上競技の理論と実践 Sprint Conditioning



骨格筋 臨床工学技士標準テキスト 第2版増補 サンダル社長のライフログ




滑り説 Wikipedia




高校生物 筋肉の張力のグラフと計算の問題の解き方を解説 高校生物の学び舎



トピックス 後口動物における筋肉の多様化 トロポニンとパラミオシンを指標とした研究 ウミユリの筋はトロポニン調節系を欠損し パラミオシンを保有しているー



生体 生命 資料 筋肉



高輝度x線回折により遺伝性骨格筋疾患の発症メカニズムを解明 少量の生検試料から診断が可能に プレスリリース Spring 8 Web Site




高校生物 収縮メカニズム 映像授業のtry It トライイット




骨格筋の収縮メカニズム アクチン ミオシン Web系エンジニアを医学生が目指してみる
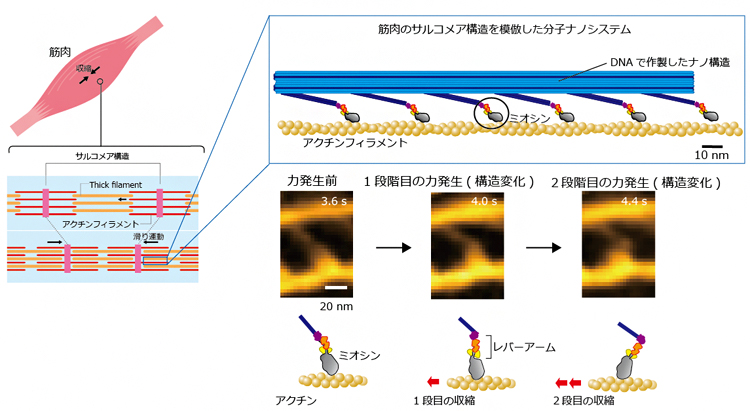



分子ナノシステムの設計から筋収縮の原理を解明 理化学研究所




筋原線維 ミオシンとアクチンの構造 筋節 A帯 I帯 H帯 Z帯 Youtube
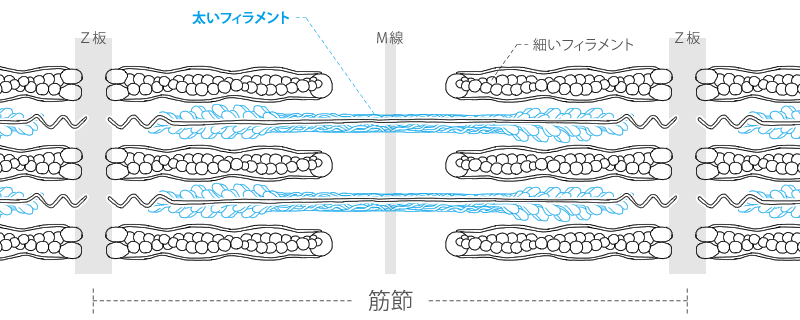



筋のタンパク質 アクチン ミオシン



筋のタンパク質 アクチン ミオシン




筋収縮はどのようなメカニズムで収縮するのか 痛み取り専門 楽楽痛み研究会 公式サイト
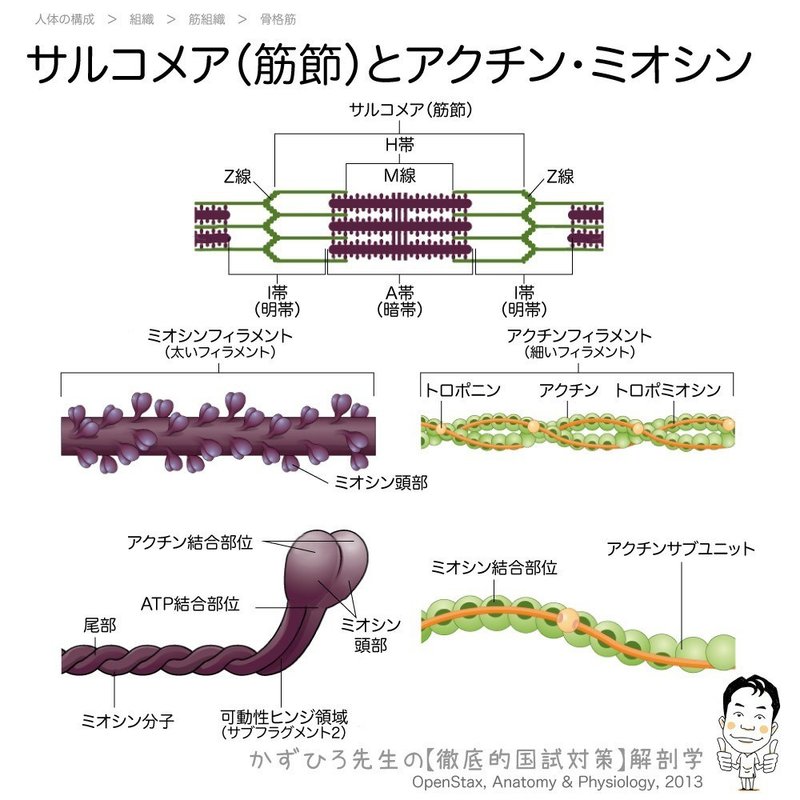



1 2 8 筋組織 解説 マガジン記事 黒澤一弘 Note
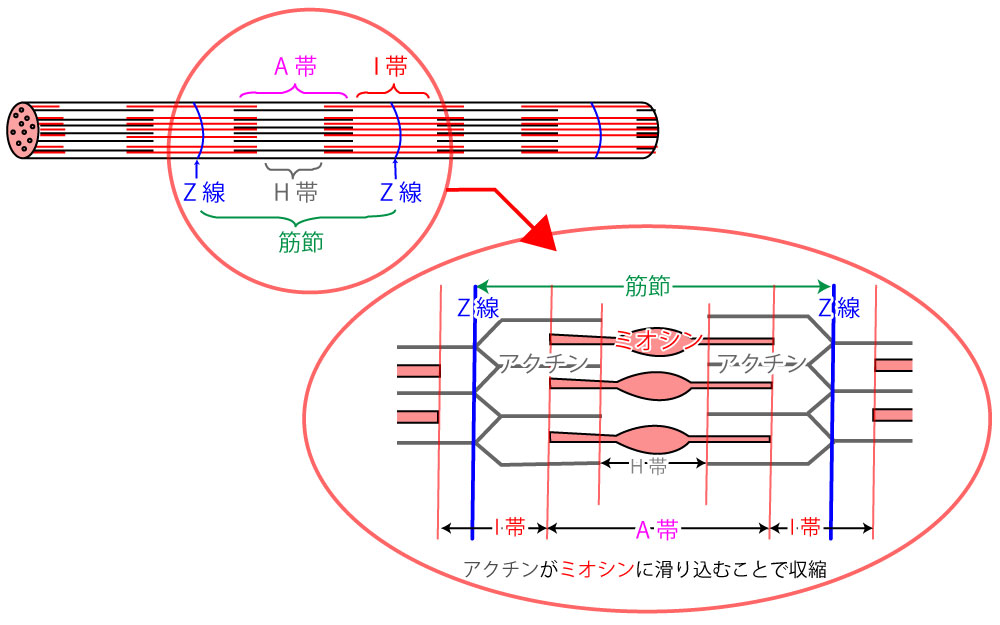



アクチンとミオシン



筋肉痛になるのはなぜ 諸説あった



迷作リメイクシリーズ104 我ら妄想族 毒にも薬にもならない話4 ニヤッとする話



1




大学入試共通テスト 生物 第2回試行調査第1問 配点12点 筋肉運動のしくみ 問題 解答 解説 船橋市議会議員 朝倉幹晴公式サイト




筋のタンパク質 アクチン ミオシン
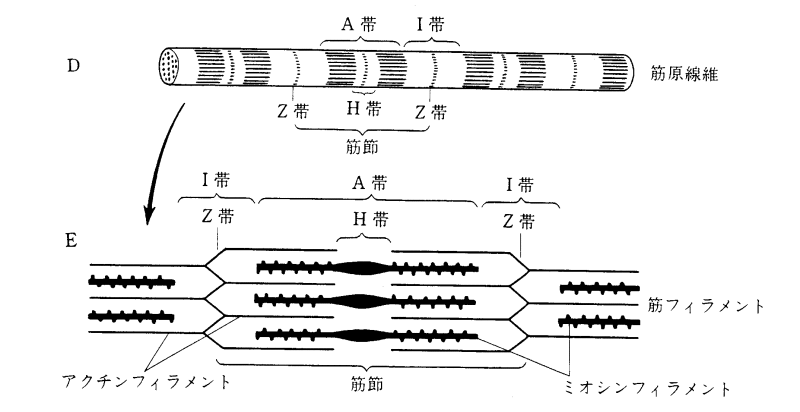



ミオシンとアクチンどちらが太い 重 巻き肩 脱力で人生は好転する




Special Story 生命をささえる運び屋分子 Brh Jt生命誌研究館
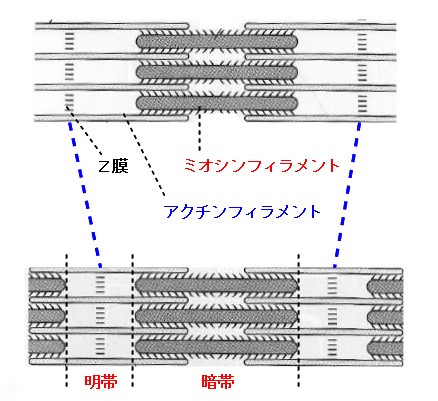



筋肉の構造と筋収縮の仕組み 筋原繊維とフィラメント
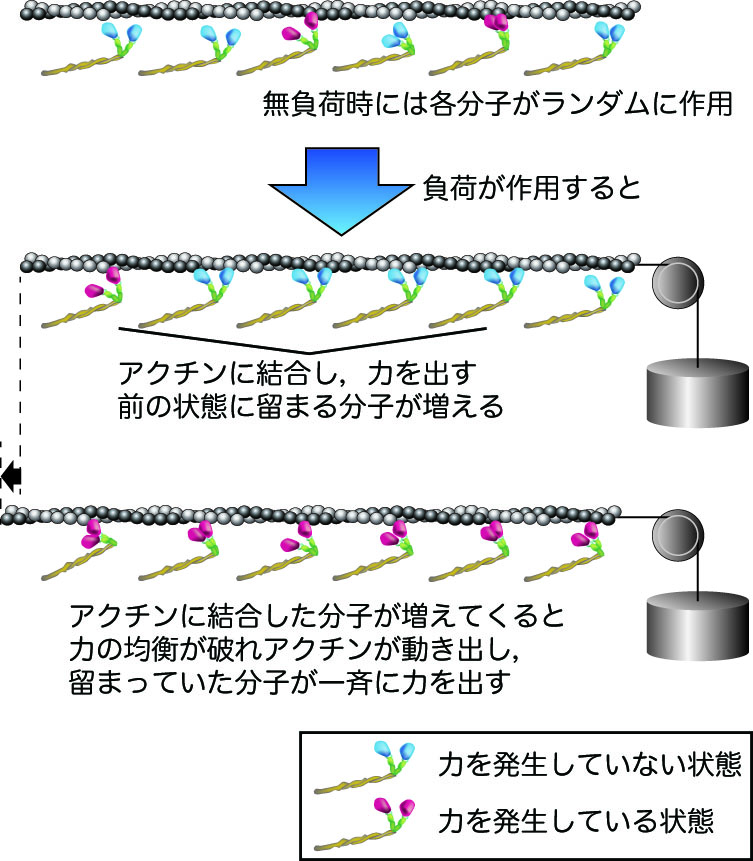



筋肉のタンパク質 ミオシンの協同的な力発生を発見 東京大学 大学院理学系研究科 理学部




骨格筋の構造 動く 3 看護roo カンゴルー




新たなタイプの心不全薬シーズの登場 日経メディカル




ヒポキャンパス در توییتر 筋収縮のメカニズム Ca濃度が上がる Caがtncに結合する Tniがアクチンから離れる トロポミオシンが アクチンの溝に移動する するとアクチンとミオシンがくっつく あとは首振り説に従ってatpを使って滑りまくる




古寺 哲幸氏 動くミオシンの撮影に成功 Nature 著者インタビュー Nature Nature Portfolio



筋肉のタンパク質 ミオシンの協同的な力発生を発見 東京大学 大学院理学系研究科 理学部



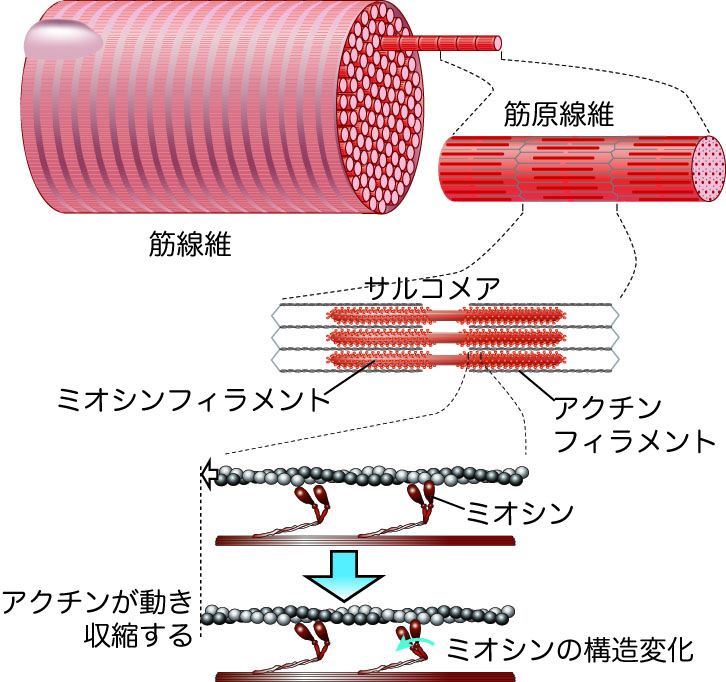
筋のタンパク質 アクチン ミオシン




筋肉の動き 予防医学センター臨床疫学藤田伸輔
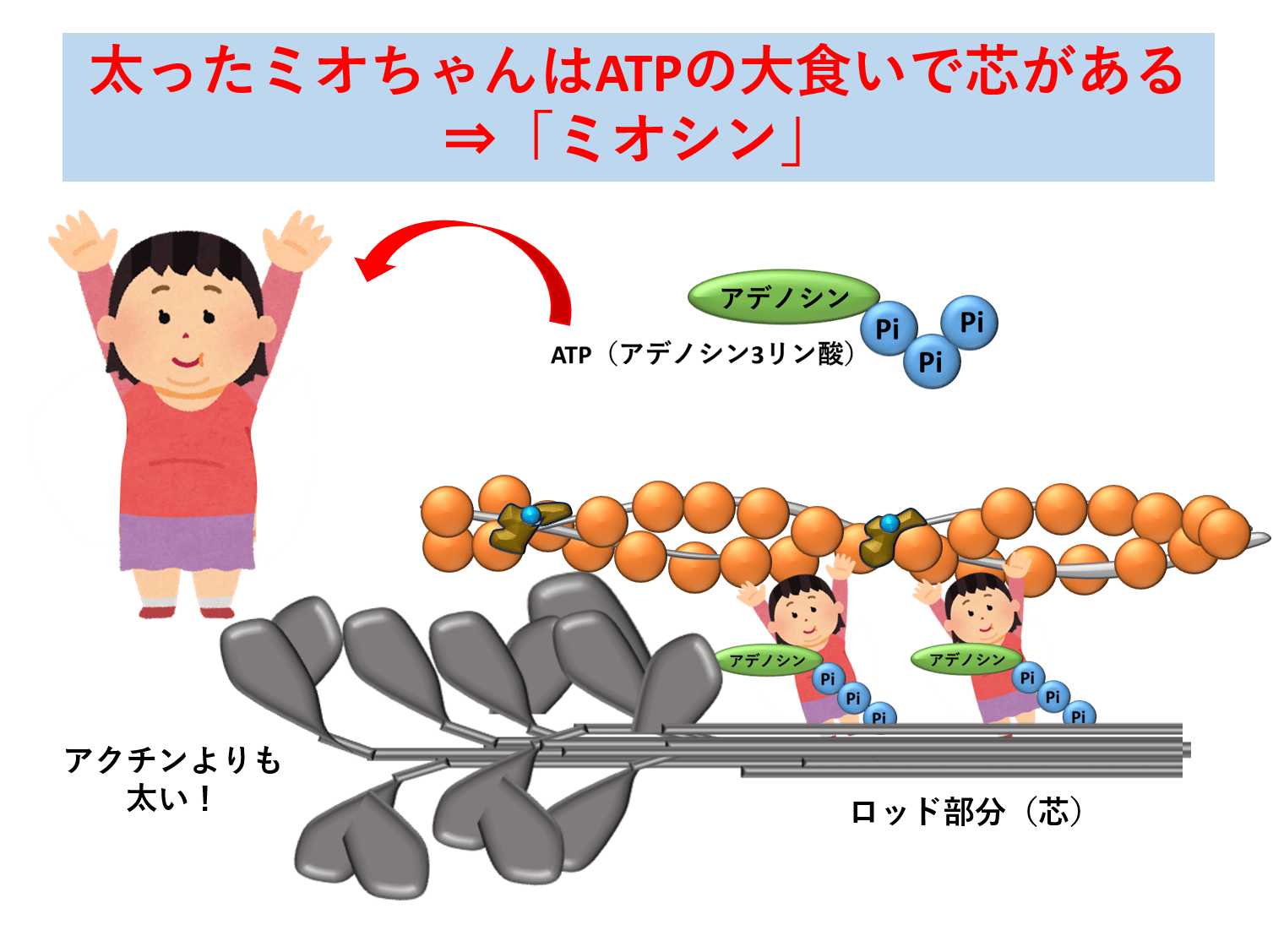



一発で覚える 筋収縮の仕組み 陸上競技の理論と実践 Sprint Conditioning
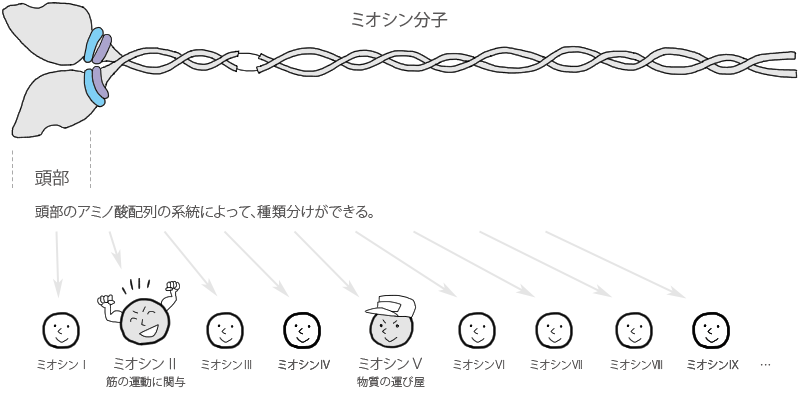



筋のタンパク質 アクチン ミオシン
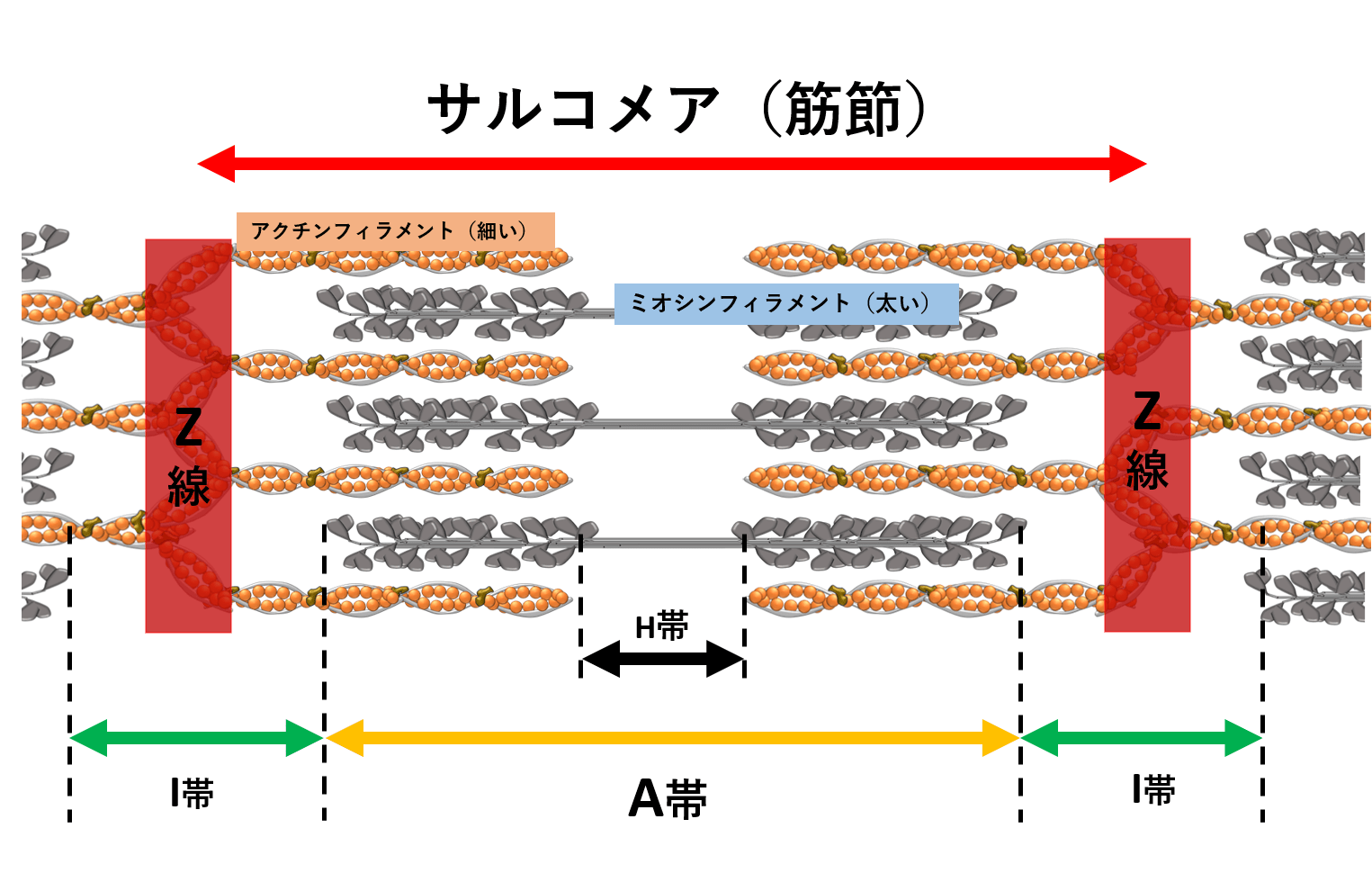



分かりやすい 筋線維の構造 筋原線維 筋小胞体 アクチンとミオシン 陸上競技の理論と実践 Sprint Conditioning




筋収縮はどのようなメカニズムで収縮するのか 痛み取り専門 楽楽痛み研究会 公式サイト
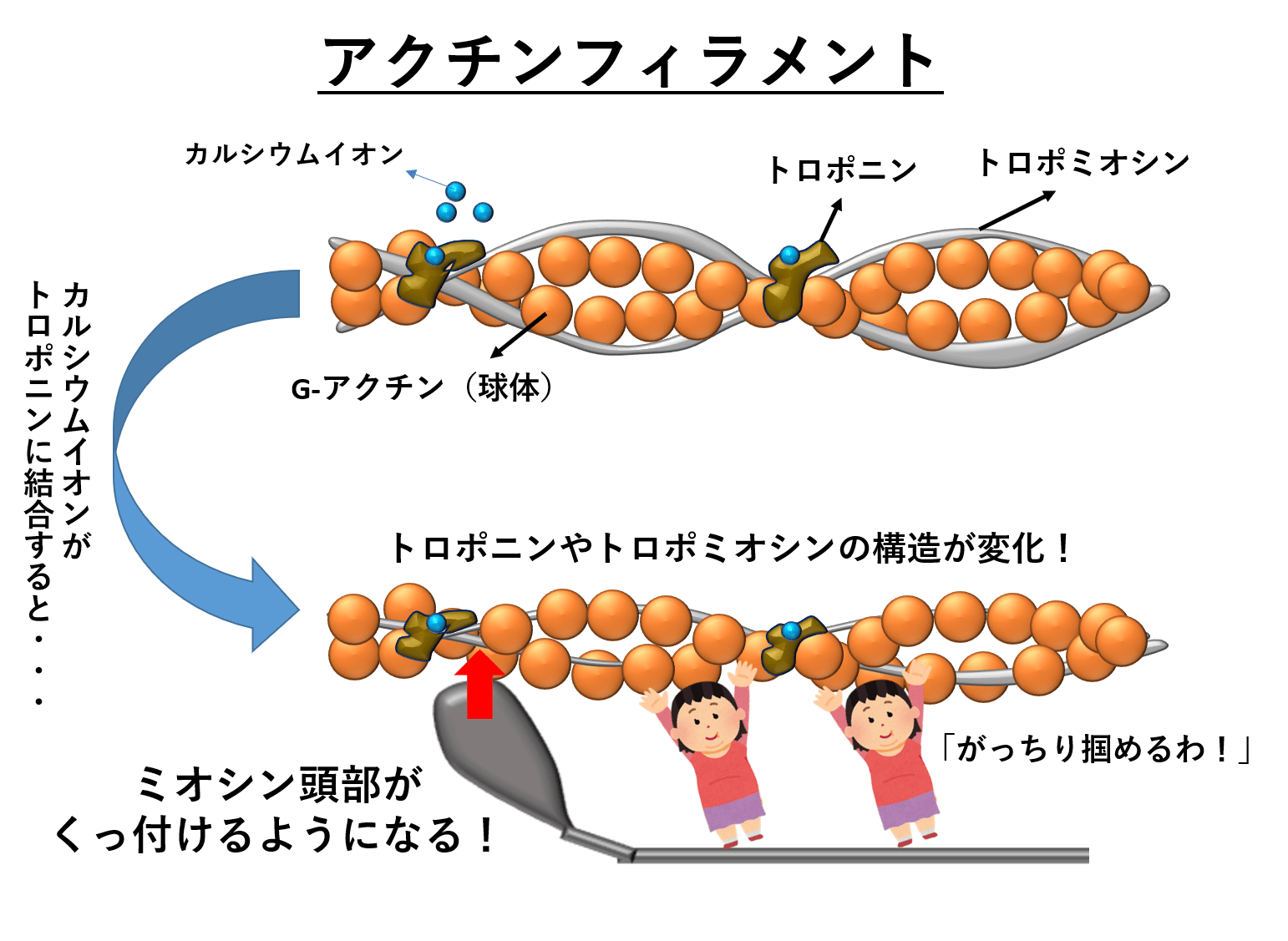



一発で覚える 筋収縮の仕組み 陸上競技の理論と実践 Sprint Conditioning




高校生物 明帯と暗帯 映像授業のtry It トライイット



美味しいサイエンス サイエンスカフェ Demems ディーメンズ サイエンスカフェ Demems ディーメンズ
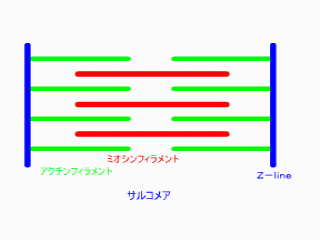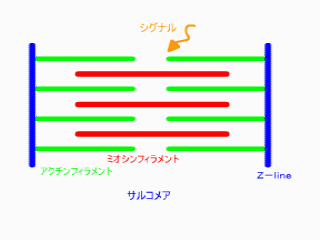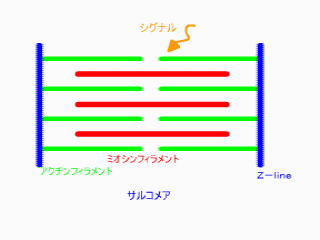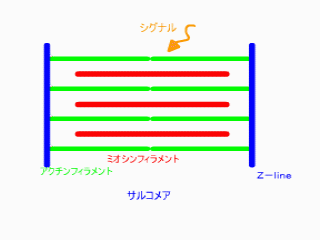



無題ドキュメント




筋肉が高エネルギー効率である仕組みを分子レベルで解明 プレスリリース 東京大学 大学院理学系研究科 理学部




高校生物 筋繊維の構造 映像授業のtry It トライイット



なんでスッキリ軽くなるの



高校生物の質問です ミオシンはアクチンフィラメント上を歩き Yahoo 知恵袋



筋肉の働き 滑り説とは バイオハックch
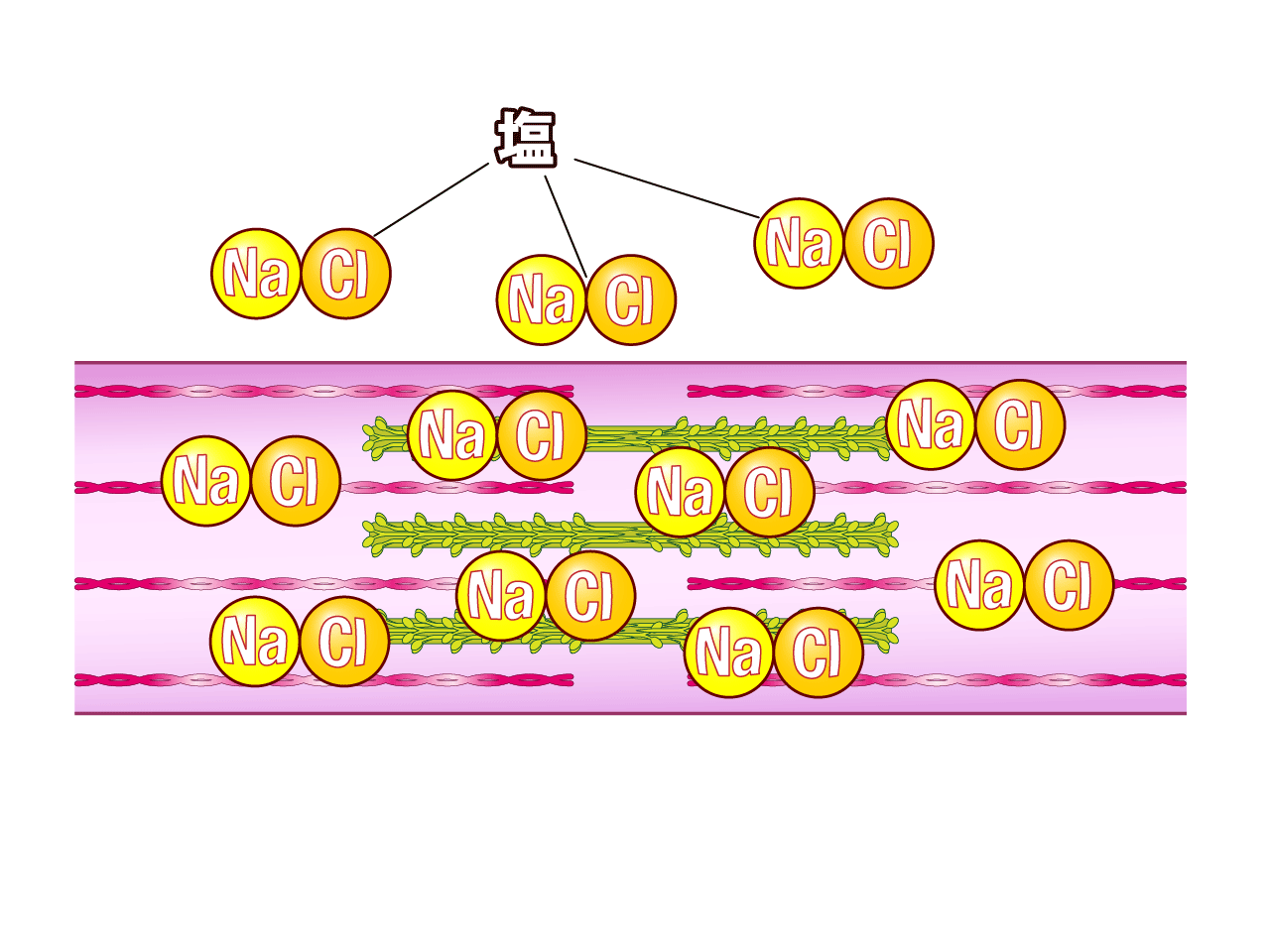



基礎 塩と加熱が不可欠な練りもの 練りもの 教室 紀文アカデミー 紀文食品




筋収縮時のアクチンとミオシンの動き 1 かずひろ先生の 徹底的国試対策 解剖学 Facebook
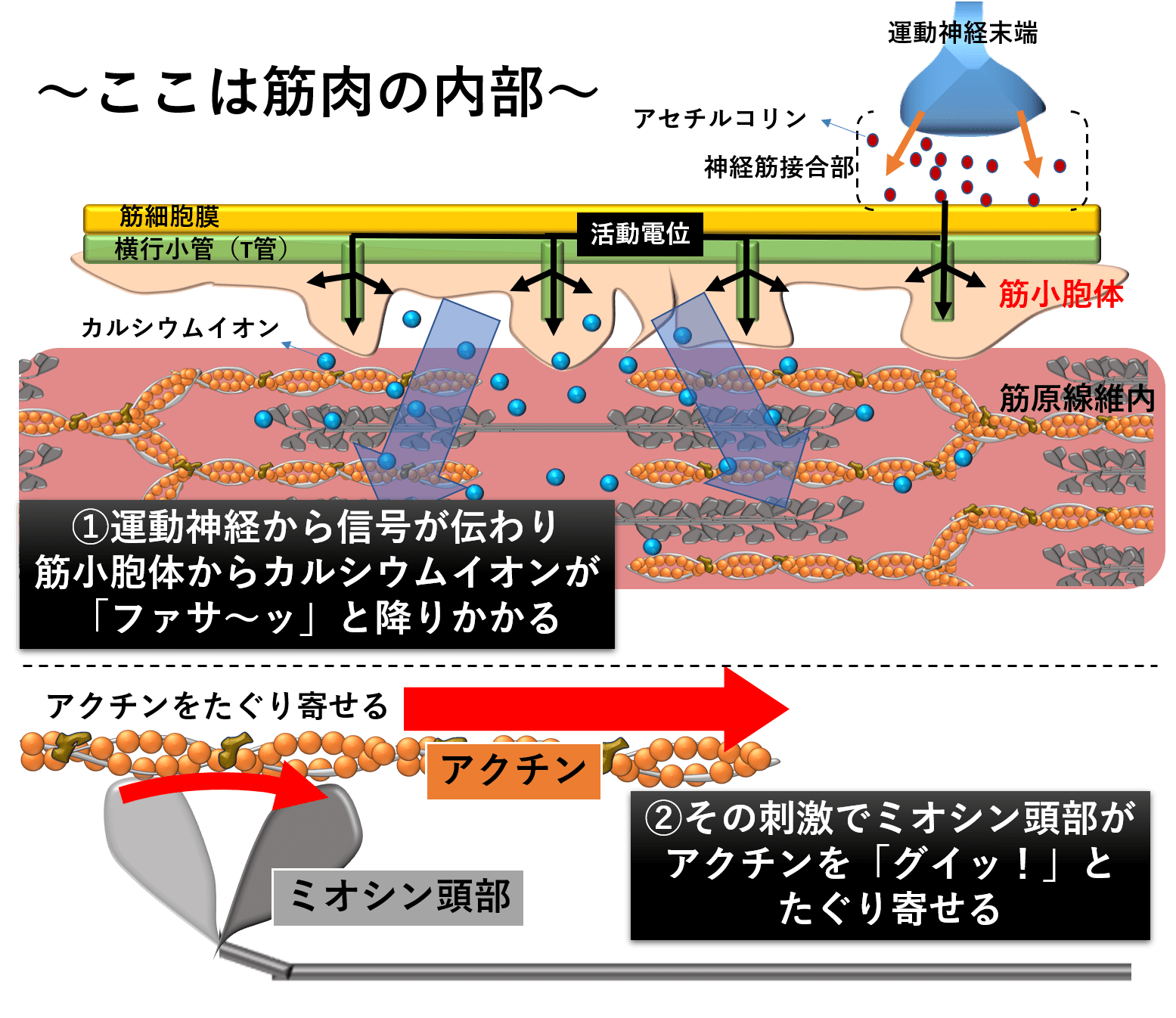



一発で覚える 筋収縮の仕組み 陸上競技の理論と実践 Sprint Conditioning




骨格筋の構造 動く 3 看護roo カンゴルー



Sts Home




筋収縮のメカニズム と アクチン ミオシン の覚え方
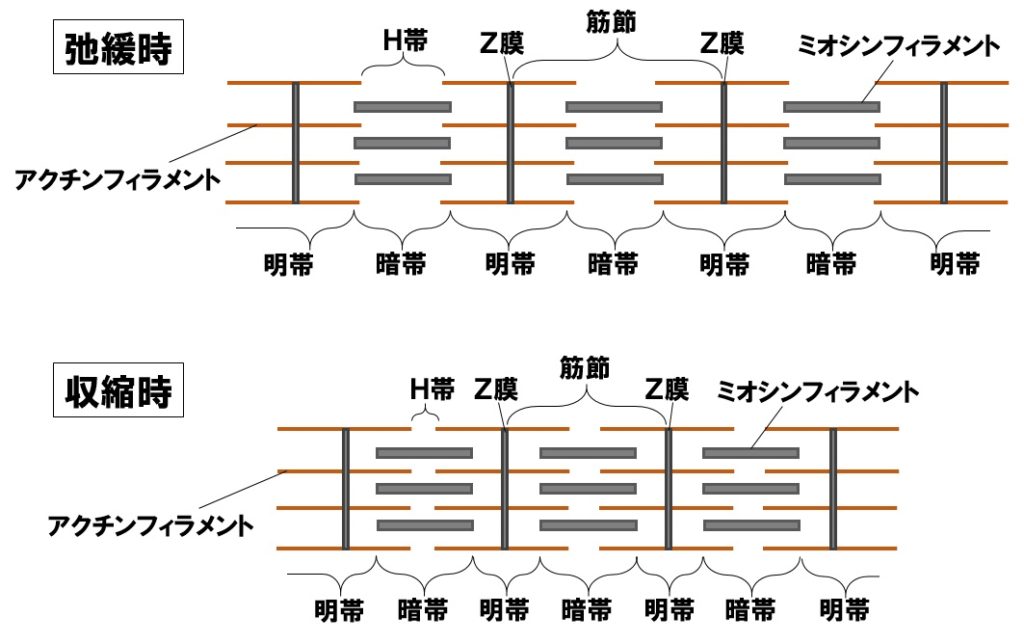



筋原繊維 筋収縮のしくみ 筋小胞体やトロポミオシンの動き Tekibo
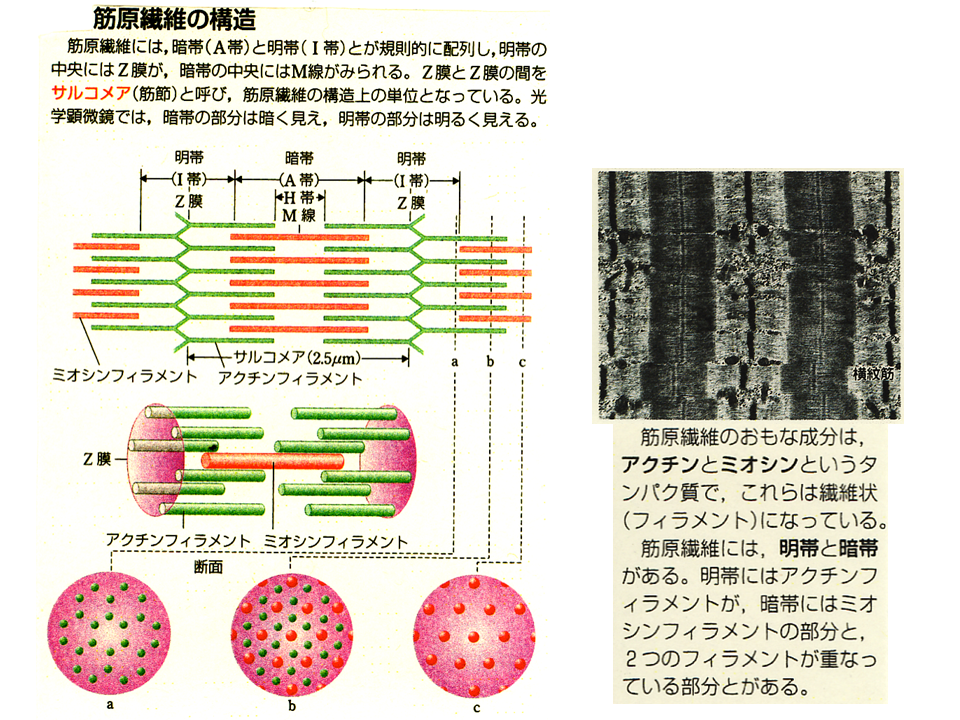



宮崎研究室筋肉の発生




アクチン




生体を動かすタンパク質
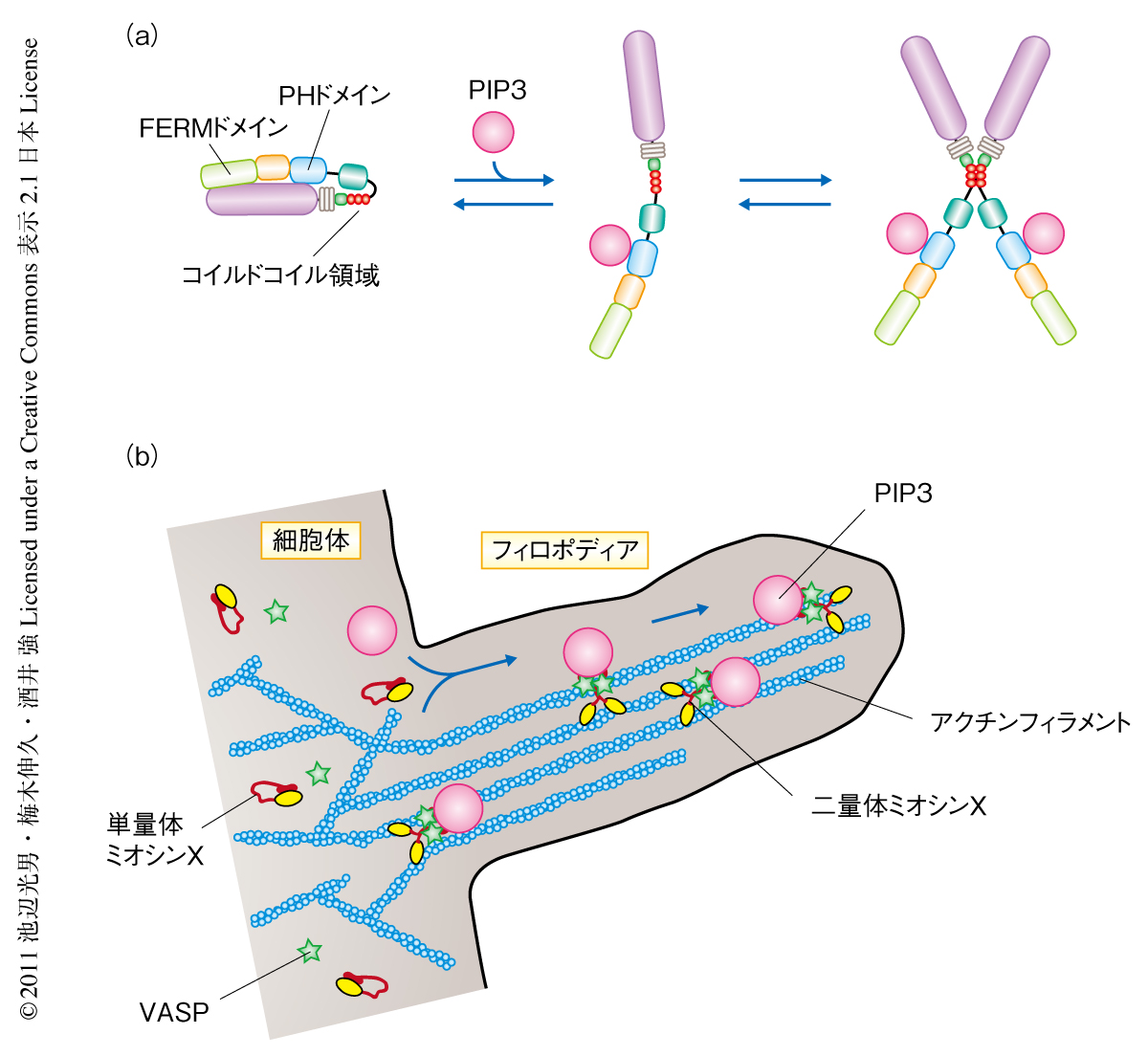



ミオシンxの物質輸送活性はリン脂質との結合により調節される ライフサイエンス 新着論文レビュー




筋肉が動くしくみとは 横浜市保土ヶ谷区のcortisパーソナルトレーニングジム



筋収縮を調節する分子メカニズムの一端を解明




骨格筋の収縮と弛緩 Study Channel



ミオシンの柔道



動く生き物大辞典 サルコメア



高輝度x線回折により遺伝性骨格筋疾患の発症メカニズムを解明 少量の生検試料から診断が可能に プレスリリース Spring 8 Web Site




構造骨格筋サルコメアを持つミオブリルアクチンとミオシンのクローズアップ アクチンのベクターアート素材や画像を多数ご用意 Istock
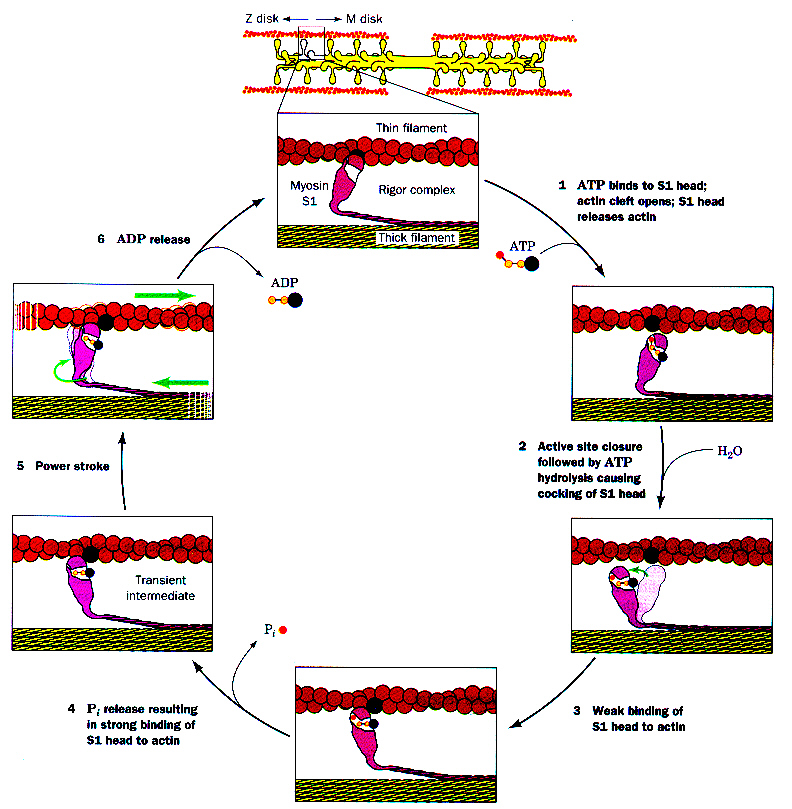



Signal




D 効果器
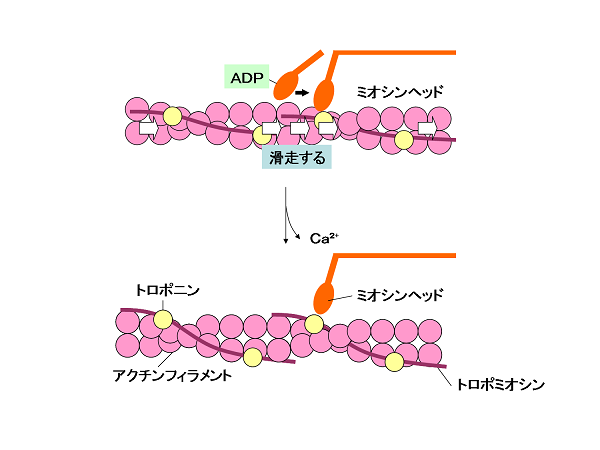



細胞内のタンパク質 モータータンパク質 バイオハックch
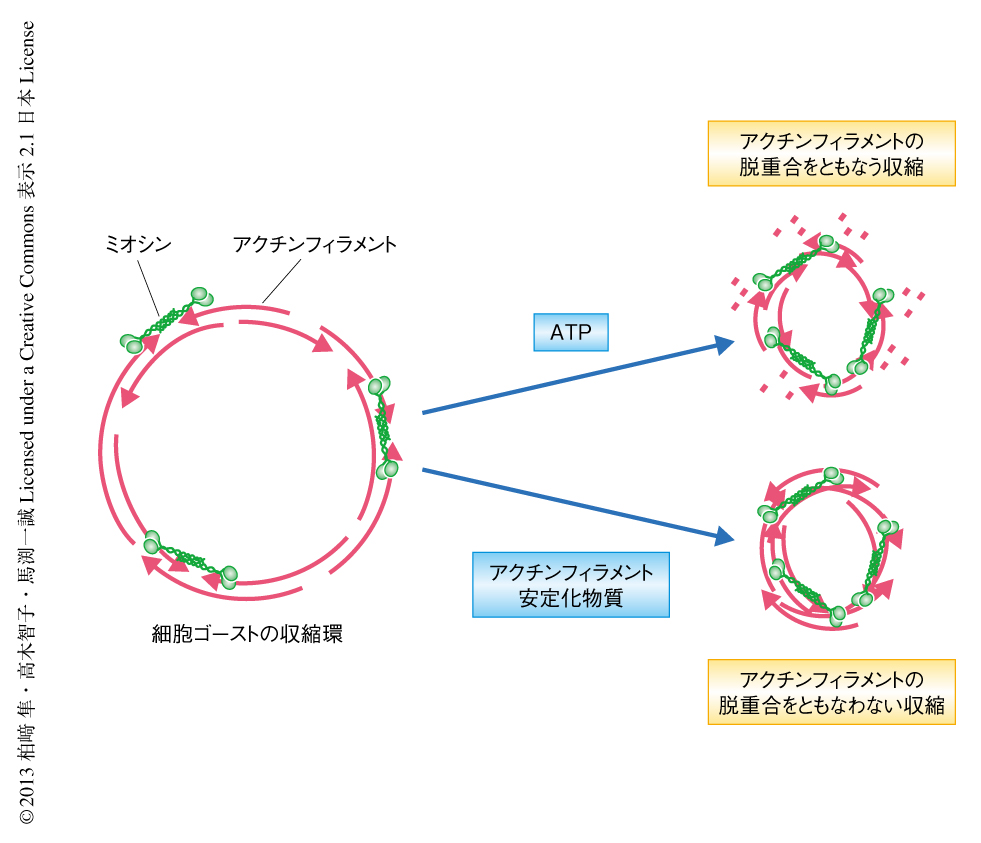



In Vitroにおける収縮環の収縮はミオシンiiに依存するがアクチンのダイナミクスには依存しない ライフサイエンス 新着論文レビュー




カブトガニの尾に隠されたパワー 微小筋肉の巨大な 力 のしくみ 杉 晴夫 ブルーバックス 講談社 2 2



0 件のコメント:
コメントを投稿